图解表观遗传学 | 组蛋白修饰
一、组蛋白结构
在了解组蛋白修饰前,先复习一下幼儿园学过的组蛋白结构。
我们都知道在细胞核中的染色体是高度压缩的,而折叠时DNA缠绕的就是组蛋白。
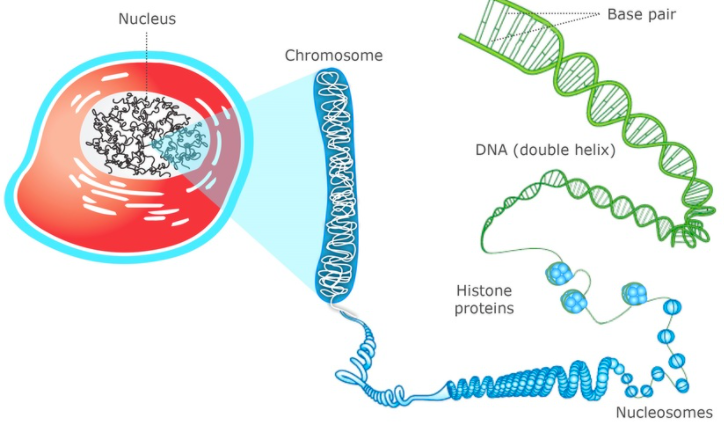
将组蛋白区域放大,我们就会看到这样一串念珠,组蛋白被一根DNA序列串起来。
为了方便研究,我们将一个组蛋白和其附近 147bp DNA片段,叫一个核小体。也就是说,
核小体 = 组蛋白 + DNA(147bp)

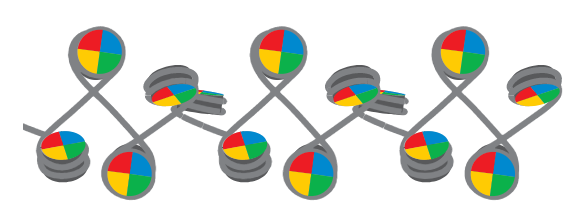
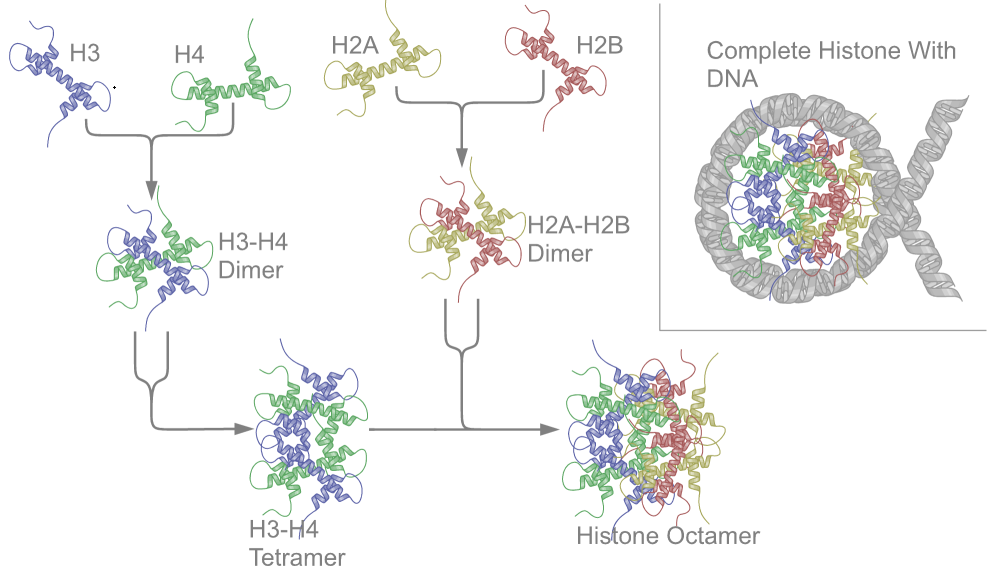
把组蛋白拆开来,它其实有八个部分来构成:
组蛋白八聚体 = 2个H2B + 2个H2A + 2个H3 + 2个H4
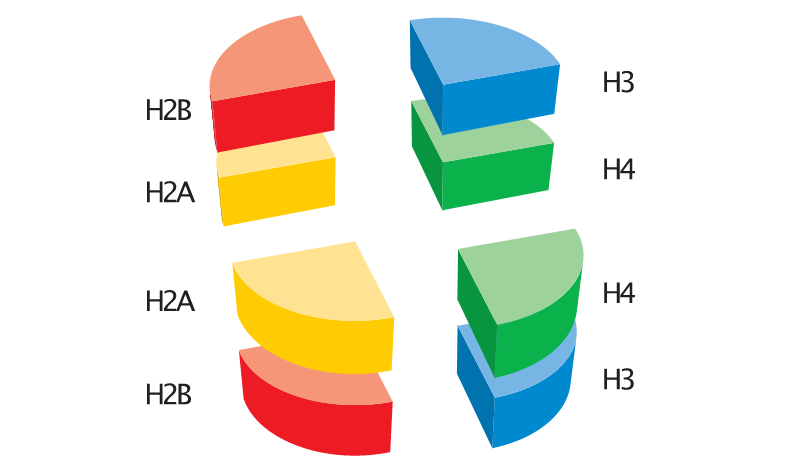
下面是检测到的组蛋白三维结构示意图,
细心的你们一定会发现在每种组蛋白结构都会伸出来一小段“线头”,这是蛋白质的N端,也叫尾巴(tail)。
事实上,每个组蛋白结构都会延伸出这个“尾巴”:
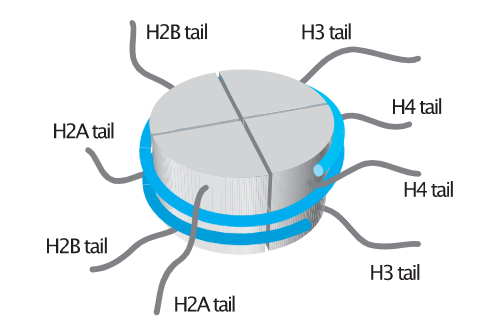
我们今天的主角,组蛋白修饰就是在这个尾巴上进行的。
二、组蛋白修饰的描述规则
这种修饰时一种以共价方式进行的蛋白质翻译后修饰(PTM),包括:甲基化(M),磷酸化(P),乙酰化(A)等等。
由于组蛋白修饰的类型众多,所以我们需要在称呼组蛋白修饰时,有一个规则:
组蛋白结构 + 氨基酸名称 + 氨基酸位置 + 修饰类型
在实际的应用中,我们一般这样写:
- H3K4me3:代表H3组蛋白的第4位赖氨酸的三甲基化
- H3K14ac:代表H3组蛋白的第14位赖氨酸的乙酰化
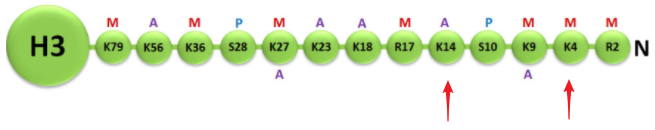
这些修饰都会影响基因的转录活性。而组蛋白H3是修饰最多的组蛋白。下面我们来详细看看:
三、组蛋白修饰类型
1、组蛋白甲基化
甲基化取决于其位置和状态,与抑制或激活有关。
组蛋白甲基化的位点是赖氨酸和精氨酸。
赖氨酸可以分别被一、二、三甲基化,精氨酸只能被一、二甲基化。
研究表明,组蛋白精氨酸甲基化是一种相对动态的标记,精氨酸甲基化与基因激活相关。
相反,赖氨酸甲基化似乎是基因表达调控中一种较为稳定的标记。
例如,
- H3K4 的甲基化与基因激活相关
- H3K9,H3K27单甲基化与基因激活有关,三甲基化与基因沉默相关
- H3K9,H3K27甲基化会介导异染色质的形成
2、组蛋白乙酰化
组蛋白甲基化和乙酰化主要发生在它们的N-末端尾部并且可以影响基因的转录。
组蛋白乙酰化主要与基因激活有关,组蛋白乙酰化主要发生在H3、H4的N端比较保守的赖氨酸位置上,是由组蛋白乙酰转移酶和组蛋白去乙酰化酶协调进行。
特定基因区域的组蛋白乙酰化和去乙酰化是以一种非随机的、位置特异的方式进行。
乙酰化可能通过对组蛋白电荷以及相互作用蛋白的影响,来调节基因转录。
| 组蛋白修饰 | 启动子 | 增强子 | 激活 | 抑制 |
|---|---|---|---|---|
| H3K4me1 | ✓ | ✓(多数) | ✓ | |
| H3K4me3 | ✓ | ✓ | ||
| H3K27me1 | ✓( 着丝粒异染色质区域 ) | ✓ | ||
| H3K27me3 | ✓( 常染色质区域 ) | ✓ | ||
| H3K27ac | ✓ | ✓ | ✓ | |
| H3K9me3 | 着丝粒异染色质区域 | |||
| H3K9me2 | 常染色质区域 | |||
| H3K9ac | ✓ | ✓ | ||
| H3K14ac | ✓ |
这些组蛋白修饰也可以共同作用来完成调控,比如,H3K9ac也与H3K14ac和H3K4me3高度共存共同作为活性基因启动子的标志。
3、其他组蛋白修饰
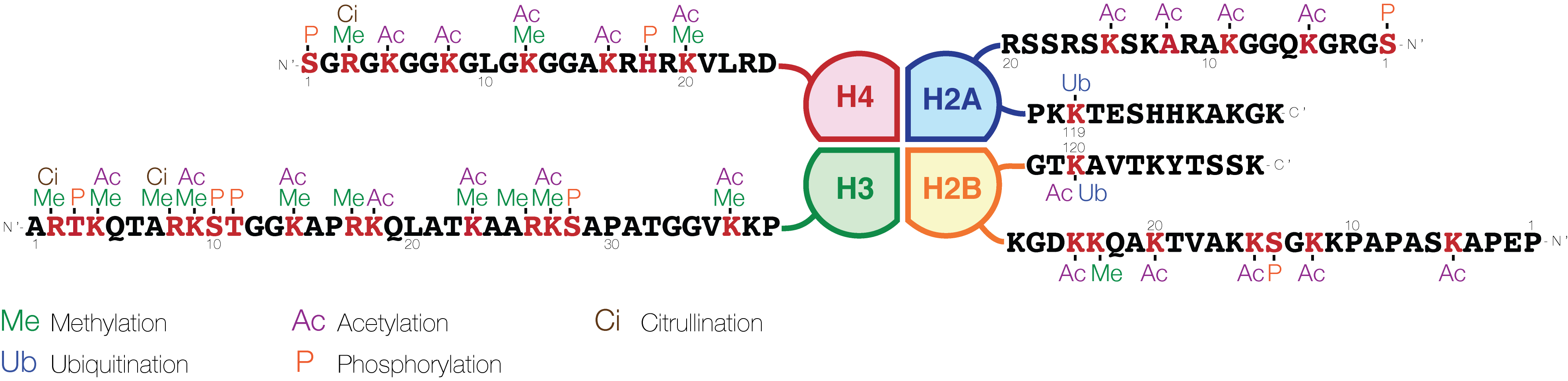
四、怎么检测组蛋白修饰
一般我们使用 ChIPseq 来对样本测序,以此来拿到全基因组上的组蛋白修饰图谱。
点击传送门:
https://zhuanlan.zhihu.com/p/279354841
参考:
https://en.wikipedia.org/wiki/Histone
Histone methylation: a dynamic mark in health, disease and inheritance. Nature Reviews Genetics ,2017
Schematic representation of histone modifications. Based on Rodriguez-Paredes and Esteller, Nature, 2011









